Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Site biology teachers lyceum № 2 Voronezh city, Russian Federation
|
Органические вещества
Органические вещества – это углеводы, липиды (жиры), белки и нуклеиновые кислоты. В органических соединениях важным элементом выступает углерод. Многочисленные превращения молекул и образование различных крупных молекул органических соединений происходят благодаря уникальному свойству углеродных атомов. Это свойство заключается в том, что атомы углерода, имеющие четыре валентные связи, способны в определенном порядке объединяться в длинные цепи и замкнутые кольцевые структуры. Эти углеродные цепи и кольца являются "скелетами" сложных органических молекул. Благодаря углероду возможно образование таких сложных и разнообразных соединений, как органические вещества. В клетках живых организмов синтезируются всевозможные большие и малые органические молекулы. Малые молекулы называют мономерами (от греч. monos – "один" и meros – "часть", "доля"). Мономеры, как строительные блоки, могут соединяться друг с другом, образуя полимеры (греч. polys – "многочисленный"). Все молекулы белков, жиров и нуклеиновых кислот являются полимерами, а углеводы могут быть и мономерами, и полимерами. Белки
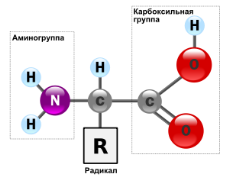
Из всех органических веществ основную массу в клетке (50–70%) составляют белки. Оболочка клетки и все ее внутренние структуры построены с участием молекул белков. Белки, или протеины (греч. протос — первый),– это сложные (высокомолекулярные) органические вещества, молекулы которых состоят из мономеров (соединённых в цепочку аминокислот) и выполняющие в клетке важные функции. Другими словами, они представляют собой гигантские полимерные молекулы, мономерами которых являются аминокислоты.
20 важнейших аминокислот служат мономерными звеньями, из которых построены все белки, соответствуют общей формуле RCH(NH2)COOH. Различают заменимые, незаменимые и условно заменимые аминокислоты. Незаменимые аминокислоты не синтезируются в организме, а поступают в него в составе белков пищи. Их отсутствие или недостаток приводит к остановке роста, нарушениям обмена веществ и даже к гибели организма. Условно заменимые аминокислоты могут синтезироваться в организме из других аминокислот. Заменимые аминокислоты способны синтезироваться в организме в необходимом количестве. 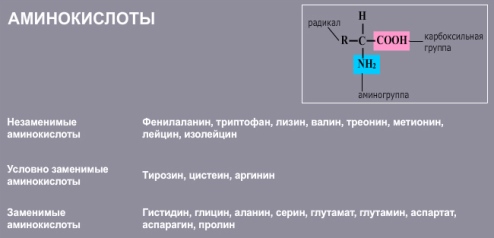 При биосинтезе белка порядок и последовательность расположения аминокислот задаются последовательностью нуклеотидов ДНК. В природе известно более 150 различных аминокислот, но в построении белков живых организмов обычно участвуют только 20. Благодаря особенностям своего химического строения аминокислоты способны соединяться друг с другом, образуя так называемую первичную структуру белка. Уникальность (специфичность) белка определяется именно последовательностью соединения определенных аминокислот. Молекулы белков могут образовывать не только первичную структуру, но и вторичную, третичную и четвертичную. Рассмотрим возможные структуры белков на примере гемоглобина. Длинная нить последовательно присоединенных друг к другу аминокислот представляет первичную структуру молекулы белка (она отображает его химическую формулу). Обычно эта длинная нить туго скручивается в спираль, витки которой прочно соединены между собой водородными связями. Спирально скрученная нить молекулы – это вторичная структура молекулы белка. Такой белок уже трудно растянуть. Свернутая в спираль молекула белка затем скручивается в еще более плотную конфигурацию – третичную структуру. В результате такого многократного скручивания длинная и тонкая нить молекулы белка становится короче, толще и собирается в компактный комок – глобулу. Только глобулярный белок выполняет в клетке свои функции. У некоторых белков встречается еще более сложная форма – четвертичная структура. Если нарушить структуру белка, например нагреванием или химическим воздействием, то он теряет свои качества и раскручивается. Этот процесс называется денатурацией. Если денатурация затронула только третичную или вторичную структуру, то она обратима: белок может снова закрутиться в спираль и уложиться в третичную структуру (явление ренатурации). При этом восстанавливаются функции данного белка. Это важнейшее свойство белков лежит в основе раздражимости живых систем, т.е. способности живых клеток реагировать на внешние или внутренние раздражители. Функции белков. Многие белки выполняют роль катализаторов, которые ускоряют химические реакции, проходящие в клетке, и упорядочивают протекающие в ней процессы. Их называют ферментами. Ферменты участвуют в переносе атомов и молекул, в расщеплении и построении белков, жиров, углеводов и всех других соединений (т. е. в клеточном обмене веществ). Ни одна химическая реакция в живых клетках и тканях не обходится без участия ферментов.
Белки выполняют в клетке множество функций: ферментативную, транспортную, структурную, защитную и другие. Без белков жизнь клетки невозможна.
|
Меню сайтаНаш опросМини-чатПоиск |