Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Site biology teachers lyceum № 2 Voronezh city, Russian Federation
|
Основные свойства и функции белков Аминогруппа позволяет аминокислотам выступать в роли оснований и реагировать с кислотами. Благодаря этому аминокислоты и белки служат буферами, т. е. противодействуют изменениям кислотности и щёлочности, защищая протоплазму клетки. Для белковой молекулы характерны ещё два свойства: денатурация и ренатурация.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздаётся структура белка. Такой процесс носит название ренатурации. Явление денатурации белка знакомо всем: каждый наблюдал, как прозрачное жидкое содержимое яйца после нагревания становится плотным и непрозрачным. Свойство ренатурации широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например антибиотиков, для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства. Функции белков в клетке
Белки-ферменты Ферменты (лат. fermentum — закваска) — специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме, катализируются соответствующими ферментами.
Вещество, на которое оказывает действие фермент, называется субстратом. Вещества, получающиеся в результате ферментативной реакции, называются продуктами реакции. Направляя и регулируя обмен веществ, ферменты играют важнейшую роль во всех процессах жизнедеятельности. Классификация ферментов Обычно ферменты именуют по типу катализируемой реакции, добавляя к названию субстрата суффикс -аза (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФ-аза). По типу катализируемых реакций ферменты подразделяются на 6 классов:
Строение и механизм действия ферментов
Кофакторы могут быть как неорганическими молекулами (например, ионы металлов), так и органическими (например, гем гемоглобина). Кофакторы органической природы, способные отделяться от фермента, называют еще коферментами. Роль коферментов часто играют витамины. В молекуле фермента выделяют особую часть — активный центр. Это небольшой участок молекулы (от 3 до 12 аминокислотных остатков), где происходит связывание субстрата (или субстратов) и образуется фермент-субстратный комплекс. Свойства реакций ферментативного катализа 1. Строгая специфичность. Ферменты проявляют строгую специфичность, то есть один фермент катализирует только одну реакцию. 2. Высокая скорость. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз выше скорости реакций, идущих с участием неорганических катализаторов. Факторы, влияющие на скорость ферментативных реакций Скорость ферментативных реакций зависит от ряда факторов. 1. Температура. Большинство ферментов может работать при температуре от 0оС до 40оС. При более низкой температуре ферменты неактивны, при более высокой подвергаются денатурации. Поскольку белки в сухом состоянии денатурируют значительно медленнее, чем белки в растворенном виде, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до более высоких температур, чем те же споры или семена в увлажненном состоянии. 2. Концентрация субстрата. При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента. Скорость реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При этом происходит насыщение всех активных центров молекул фермента. 3. Концентрация фермента. Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции. 4. рН. Для каждого фермента существует оптимальное значение рН, при котором проявляется максимальная каталитическая активность (например, для пепсина оптимум рН=2,0, а для липазы поджелудочной железы рН=9,0). 5. Активаторы и ингибиторы. Скорость работы некоторых ферментов регулируется особыми веществами — активаторами (ускоряют реакцию) и ингибиторами (замедляют реакцию). Эти вещества способны присоединяться к молекулам фермента и либо облегчать связывание активного центра молекулы фермента с субстратом, либо делать невозможным образование фермент-субстратного комплекса. Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность. Существует два типа модификации: присоединение химических групп к боковым остаткам полипептидной цепи и расщепление полипептидной цепи. < Предыдущая страница "Органические вещества клетки. Белки" Следующая страница "Органические вещества клетки. Нуклеиновые кислоты" > |
Меню сайтаНаш опросМини-чатПоиск |
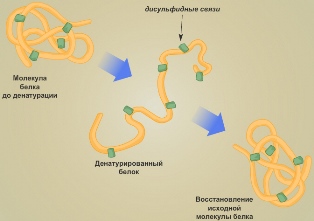 Денатурация — это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. Сначала разрушается четвертичная структура (самая слабая), затем третичная, вторичная и при наиболее жёстких условиях первичная.
Денатурация — это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. Сначала разрушается четвертичная структура (самая слабая), затем третичная, вторичная и при наиболее жёстких условиях первичная.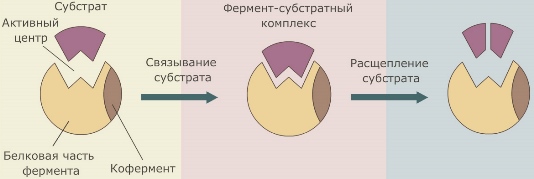
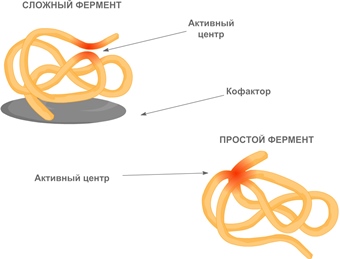 По химической природе ферменты — это глобулярные белки, состоящие либо только из аминокислот, либо в их состав входит небелковый компонент, называемый кофактором.
По химической природе ферменты — это глобулярные белки, состоящие либо только из аминокислот, либо в их состав входит небелковый компонент, называемый кофактором.

