Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Site biology teachers lyceum № 2 Voronezh city, Russian Federation
|
Органические вещества клетки. Белки Белки — обязательная составная часть всех клеток. Они состоят из многих тысяч атомов. Белки — это биополимеры, мономерами которых являются аминокислоты. В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживается лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот. Молекула любой аминокислоты состоит из двух функциональных групп: аминогруппы (-NH2) и карбоксильной группы (-СООН), присоединённых к атому углерода, таким образом, аминокислоты обладают свойствами и кислот, и оснований. Вторая часть у всех аминокислот разная. Она называется радикалом (R). Аминокислоты — это бесцветные кристаллические твердые вещества. Чистые аминокислоты, выделенные из белков, имеют сладкий вкус. Они растворяются в воде, а в органических растворителях нет. В нейтральных водных растворах проявляют свойства и кислот, и оснований. Прочие химические свойства зависят от радикала. Белки всех живых организмов на Земле содержат одни и те же аминокислоты. Биологическая роль аминокислот
Различают заменимые, незаменимые и условно заменимые аминокислоты. Незаменимые аминокислоты — кислоты, которые не синтезируются клетками животных и человека и поступают в организм в составе белков пищи. Для разных животных набор незаменимых аминокислот неодинаков. Отсутствие или недостаток незаменимых аминокислот приводит к остановке роста, падению массы, нарушениям обмена веществ и к гибели организма. Для человека это изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Условно заменимые аминокислоты могут синтезироваться в организме из других аминокислот, например тирозин из фенилаланина, цистеин из метионина. Заменимые аминокислоты способны синтезироваться в организме в достаточном количестве.
Руки человека — наиболее удобная модель для объяснения явления оптической изомерии: левая рука подобна правой, но не может быть совмещена с ней в пространстве путем перемещений и поворотов. Эта разница становится особенно заметной, если кто-то попытается надеть левую перчатку на правую руку. Все аминoкиcлoты, составляющие природные белки, oтноcятcя к L-ряду.
Белки, или протеины (греч. protos — первый) — высокомолекулярные органические вещества, полимерные молекулы которых состоят из соединенных в цепочку аминокислот. Молекулы белка — гетерополимеры линейного строения, мономерами которых являются 20 видов аминокислот. Если молекулы белка содержат весь набор аминокислот, то такой белок называется полноценным; если какие-то аминокислоты отсутствуют в составе белковых молекул, то неполноценным. Если белки состоят только из аминокислот, то их называют простыми; если они содержат еще и неаминокислотный компонент (простетическую группу), то их называют сложными. Белковые молекулы могут сворачиваться, образуя клубок (глобулу), или формировать вытянутую нитевидную структуру (фибриллу). Структуры белковых молекул Для молекул белков характерно существование нескольких структурных уровней, которые зависят как от химического состава аминокислот, их числа и порядка соединения друг с другом, типа связи, обеспечивающей образование определённого уровня, так и от состава окружающей среды. Первичную структуру белков определяет последовательность аминокислот. Она образована очень прочными ковалентными связями, названными пептидными. Отсюда и название белков — пептиды. Эти связи образуются в результате выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой.
Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая связь — пептидной связью. Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид. На одном конце его молекулы находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединить к себе другие аминокислоты. Аминокислотная последовательность белка определяет его биологическую функцию. Замена одной кислоты в молекулах данного белка может резко изменить его функцию. Замена одной-единственной аминокислоты может резко изменить эту функцию. Например, замена в β-субъединице гемоглобина шестой аминокислоты — глутаминовой кислоты — на валин приводит к тому, что молекула гемоглобина не может выполнять свою основную функцию — транспорт кислорода. Такой патологический гемоглобин содержится в крови больных серповидноклеточной анемией. Первой была открыта первичная структура гормона поджелудочной железы инсулина Ф. Сэнгером в 1949 — 1954 годах. К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется особая форма записи аминокислотной последовательности в полипептидных цепях: с помощью сокращенных трехбуквенных символов — названий аминокислот. Например, Ала-Тре-Цис-Ала-Ала-Вал-Иле-Глу-Вал-Глн-Про-Арг-Про-Вал-Гли. При этом предполагается, что аминогруппа находится слева, а карбоксильная группа — справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки — соответственно N-концевым и С-концевым остатками.
Во вторичной структуре NH-группа находится на одном витке, а СО — на соседнем. Аминокислотные радикалы остаются при этом снаружи спирали. В образовании 5 витков спирали участвуют 18 аминокислотных остатков; таким образом, на один виток спирали приходится 3,6 аминокислотных остатка. Такая регулярная спиральная структура возникает благодаря периодически чередующимся карбоксильным группам и аминогруппам в аминокислотной последовательности, которые образуют между собой водородные связи. Практически все СО- и NH-группы полипептидной цепочки принимают участие в образовании водородных связей, и, благодаря тому, что связи повторяются многократно, они придают данной конфигурации стабильность. Полностью α-спиральную вторичную структуру имеет нитевидный белок кератин. Это структурный белок волос, шерсти, ногтей, когтей, клюва, перьев, копыт и рогов, входящий также в состав кожи позвоночных.
Третий тип вторичной структуры имеет белок коллаген. Здесь три полипептидные цепи свиты вместе. Такой белок тоже невозможно растянуть, что очень важно, так как он образует сухожилия, костную ткань и другие виды соединительных тканей. Все эти белки представляют собой исключение среди прочих белков. Если рядом окажутся две молекулы цистеина, содержащие серу, то между ними образуется дисульфидный мостик (S-S связи). Третичная структура формируется у большинства белков за счёт свёртывания особым образом полипептидной спирали белка в компактную глобулу, т. е. шарообразную структуру. Третичную структуру поддерживают пептидные, водородные, дисульфидные связи, а также гидрофобные. Гидрофобные связи возникают между радикалами гидрофобных аминокислот. Эти связи слабее водородных. В водной среде в клетке гидрофобные радикалы отталкиваются от воды и слипаются друг с другом. Водная среда как бы принуждает белковую молекулу принять определённую упорядоченную структуру, и она становится биологически активной. Третичная структура не является высшей формой структурной организации белка. В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков:
2. Фибриллярные белки. Эти белки имеют вытянутую нитевидную форму. Они, как правило, выполняют в организме структурную или двигательную функции. Например, кератин, который построен из протяженных спиралей, уложенных параллельно друг другу и стабилизированных водородными связями, или коллаген, молекула которого состоит из трех полипептидных цепей.
В живой клетке обнаружено много белков, имеющих ещё более сложную структуру, например четвертичную. Четвертичная структура белковой молекулы — это объединение нескольких (двух и более) глобул в единый комплекс за счет гидрофильно-гидрофобных взаимодействий, а также при помощи водородных и ионных связей.
Отдельные глобулы называются субъединицами и обозначаются буквами греческого алфавита. У гемоглобина, например, имеется по две α и β субъединицы. Наличие нескольких субъединиц важно в функциональном отношении — это увеличивает степень насыщения кислородом. Четвертичную структуру гемоглобина обозначают как α2 β2. Белки, состоящие из нескольких субъединиц, широко распространены в природе. Четвертичная структура молекулы свойственна, например, большинству ферментов. У животных, растений, микроорганизмов были извлечены и изучены тысячи разных белков. Поражает разнообразие физических и химических свойств белков, что обусловлено их различным аминокислотным составом. |
Меню сайтаНаш опросМини-чатПоиск |
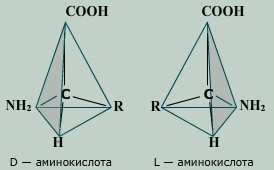 Стереохимия аминокислот. Для вcех молекул аминокислот, кpoмe глицина, характерно наличие оптических изомеров, то есть зеркально подобных форм молекул. Их называют L-аминокислотами и D-аминокислотами.
Стереохимия аминокислот. Для вcех молекул аминокислот, кpoмe глицина, характерно наличие оптических изомеров, то есть зеркально подобных форм молекул. Их называют L-аминокислотами и D-аминокислотами.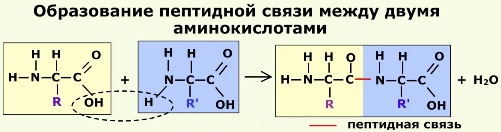
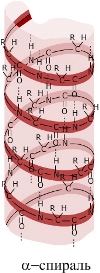 Вторичная структура поддерживается водородными связями между группами СО и NH и может быть представлена α-спиралью и β-слоем.
Вторичная структура поддерживается водородными связями между группами СО и NH и может быть представлена α-спиралью и β-слоем.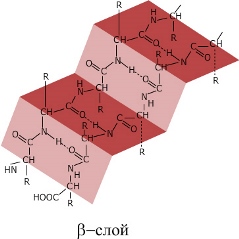 Другой тип вторичной структуры (β-слой) — складчатый у белка
Другой тип вторичной структуры (β-слой) — складчатый у белка 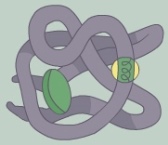 1. Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара — глобулы.
1. Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара — глобулы. 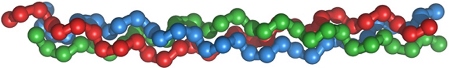
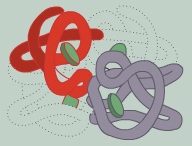 Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, различающихся по первичной структуре. Объединяясь, они создают сложный белок. Например, молекула
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, различающихся по первичной структуре. Объединяясь, они создают сложный белок. Например, молекула 

